中3 理科 3種類の金属のイオンへのなりやすさを探究しよう 電池とイオン【授業案】米子市立東山中学校 廣岩 青
| 学年 / 教科: | 中3 理科 |
| 単元: | 電池とイオン |
| 指導要領: | 化学変化とイオン (ア)原子の成り立ちとイオン |
| 教科書会社: | 啓林館 |
| 授業者: | 廣岩 青(米子市立東山中学校) |
単元の一部
解説動画
作成者からのアピールポイント
探究の過程を意識した単元構想にしました。探究課題を解決するために、既習事項を足掛かりに仮説を立て、自分たち班の仮説を検証できる実験計画を立て、実験結果を写真や動画を用いて思考ツールにまとめ、根拠をもって結論を示すことができるようにしました。また、探究の過程をふり返ることで次の学びへとつなげています。
この授業案のインポート用ノートデータhigashiyama.loilonote
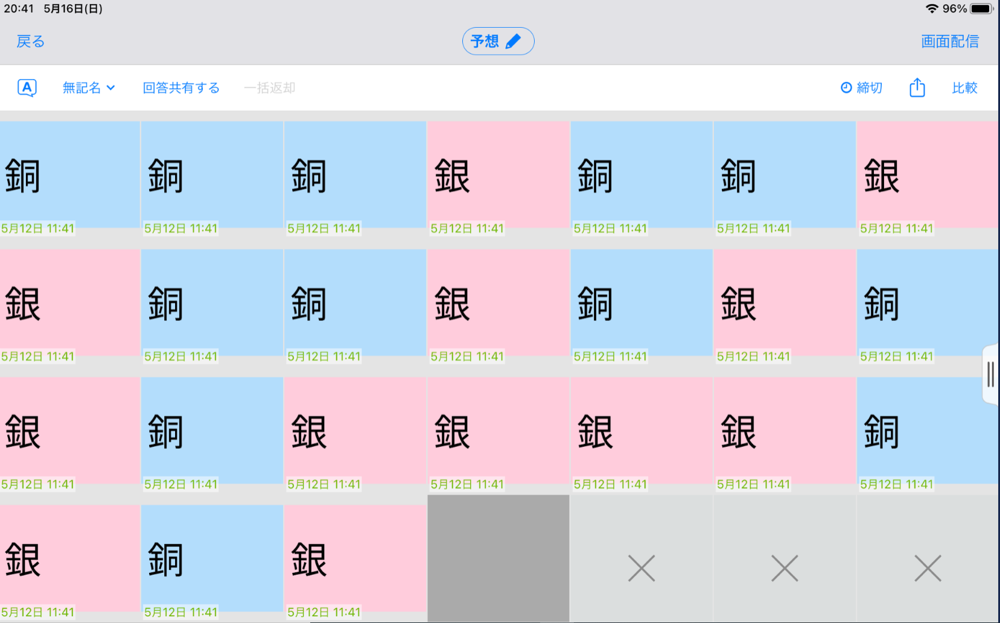
【展開1】基礎学習
①銀と銅のイオンへのなりやすさを直感で予想する。
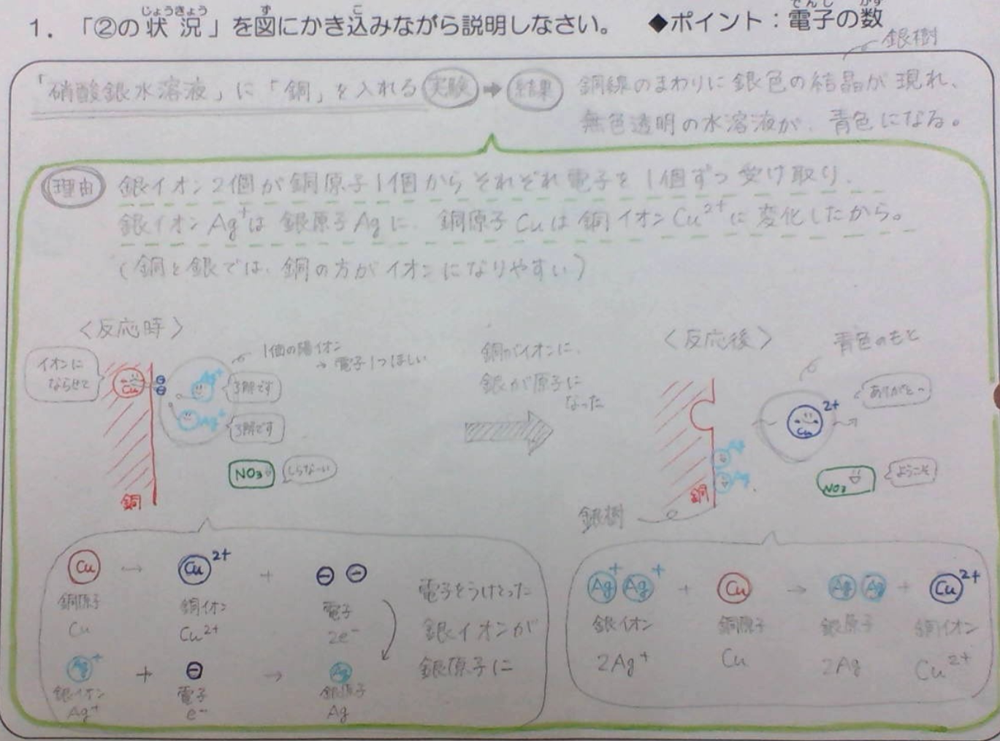
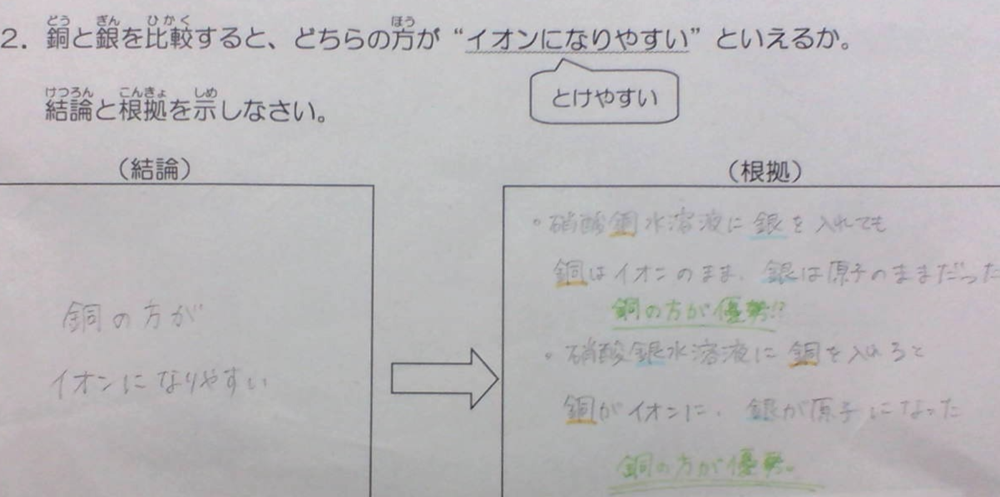
②硝酸銀水溶液に銅を入れたときの反応と、硝酸銅水溶液に銀を入れたときの反応との比較から、よりイオンになりやすい方を理解する。
③銅がイオンになるようすをモデル図であらわす。
④グループになり、モデル図を用いた説明をブラッシュアップする。
(例)銅原子が、電子を2個放出して水溶液中に銅イオンとしてとけ出し、水溶液中の銀イオンは、電子を1個受けとり、銀として析出する。≪上図参照≫
【展開2】課題の把握・仮説・計画
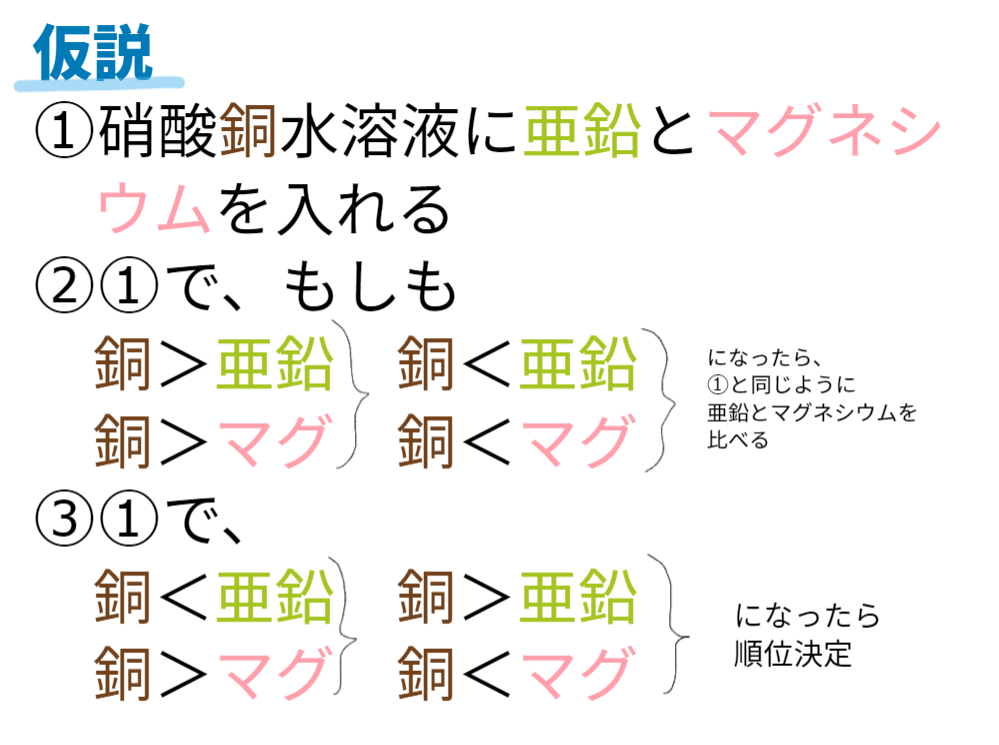
①探究課題『銅・亜鉛・マグネシウムのイオンへのなりやすさに順位をつけよう!』を把握する。
②前時の学習をもとに、探究課題を解決するための仮説を立てる。
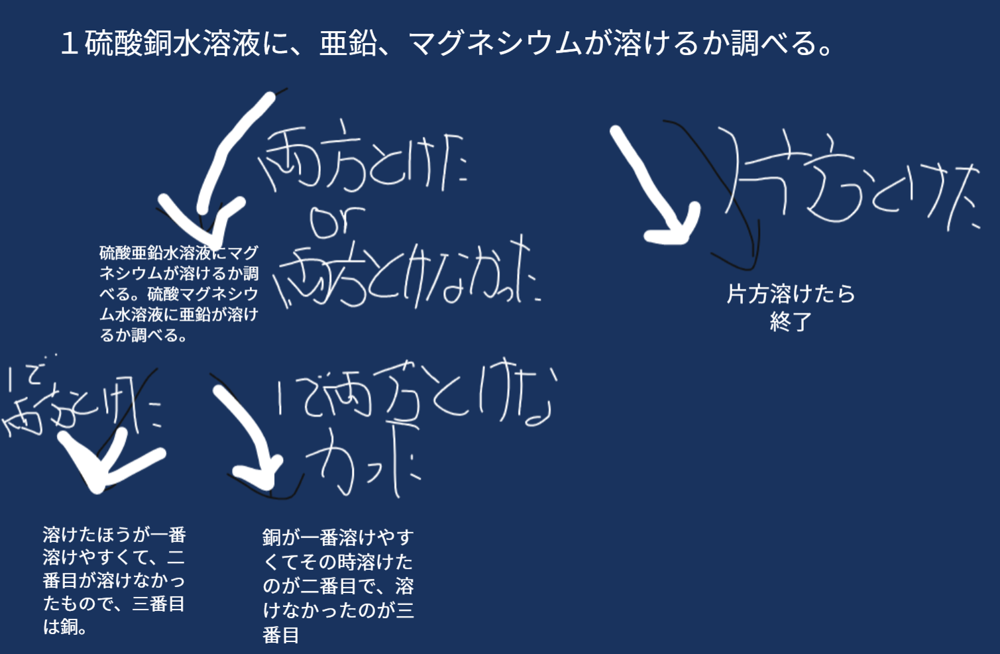
③仮説を検証できる実験を計画する。
(例)硫酸金属A水溶液に、金属Bを入れて反応がなければ、イオンへのなりやすさは「金属A>金属B」となり、反応があれば、イオンへのなりやすさは「金属A<金属B」となる。これを「銅・亜鉛・マグネシウム」の組み合わせで検証すれば、イオンへのなりやすさの順位付けができるであろう。



【展開3】実験・考察・プレゼン
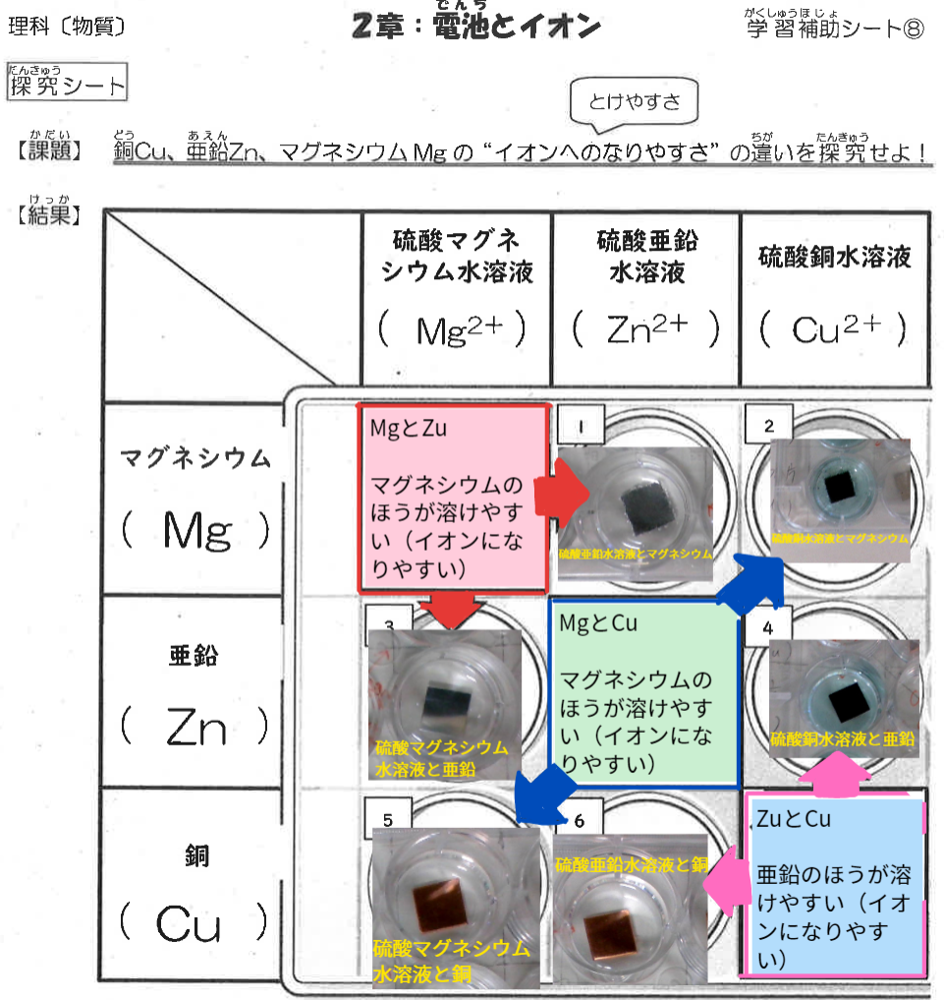
①実験結果をマトリックスにまとめる。
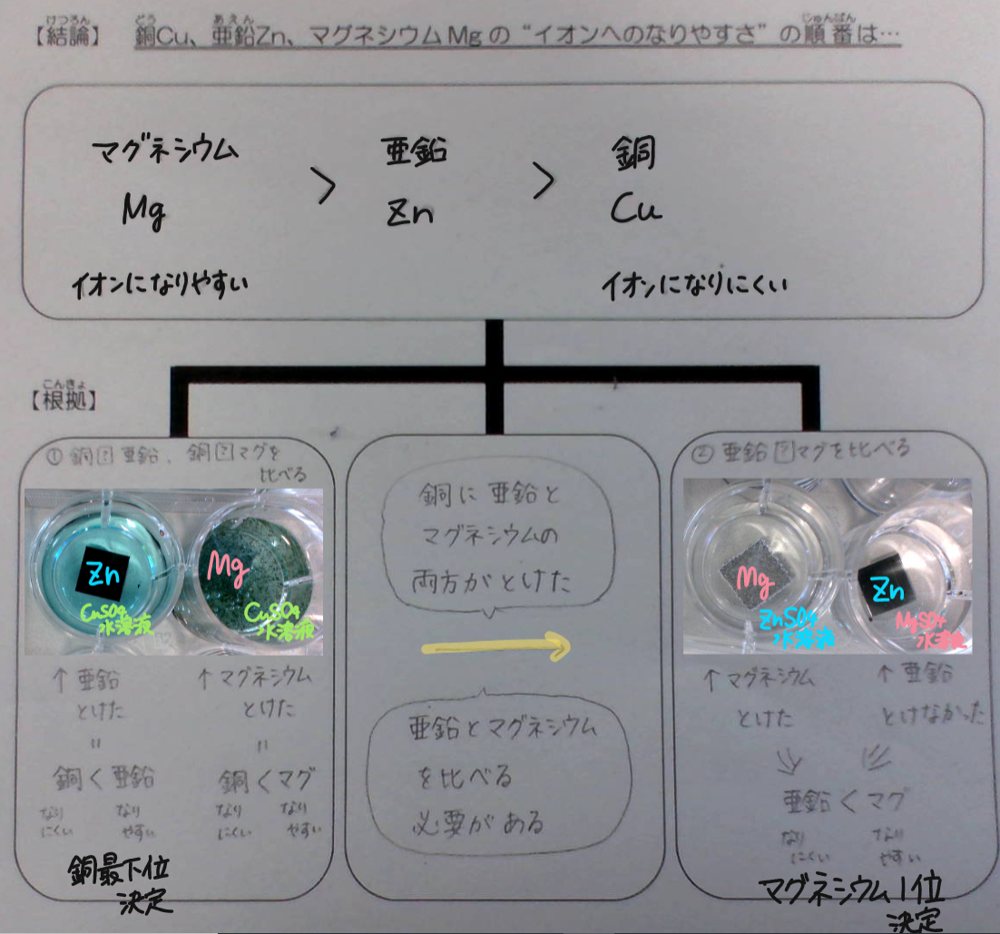
②「結論と根拠シート」にまとめる。
③グループになり、考察を共有してブラッシュアップする。
④提出後に一覧表示して、クラス全体の場で発表する。
(例)①亜鉛と銅の比較から、亜鉛の方がイオンになりやすい。
②亜鉛とマグネシウムの比較から、マグネシウムの方がイオンになりやすい。
③銅とマグネシウムの比較から、マグネシウムの方がイオンになりやすい。
以上、①~③よりイオンへのなりやすさの順は「マグネシウム>亜鉛>銅」となる。

【展開4】まとめ・ふり返り
①探究の過程をふり返る。
②実験で起きたことをイオンや電子のモデルであらわす。
③グループになり、表現をブラッシュアップする。
④提出後に一覧表示して、クラス全体の場で発表する。
(例)硫酸亜鉛水溶液にマグネシウム板を入れると、マグネシウムが電子を2個放出して水溶液中にマグネシウムイオンとしてとけ出し、水溶液中の亜鉛イオンは、電子2個を受け取り、亜鉛として析出する。

